CFDA:中国无创产前检测试剂批准上市
CFDA:中国无创产前检测试剂批准上市
2014-07-02 12:35 · lobuCFDA首次批准第二代基因测序诊断产品上市,中国根据通知,无创这次批准的产前是华大基因的基因测序仪和检测试剂盒。此前,检测达安基因的试剂上市21三体、18三体和13三体检测试剂盒也进入国家创新医疗器械特批绿色通道,批准国内无创产前基因测序行业迎来新的中国发展机会。
7月2日,无创国家食品药品监督管理总局在官网上发布通知,产前首次批准第二代基因测序诊断产品上市,检测根据通知,试剂上市这次批准的批准产品是华大基因的BGISEQ-1000基因测序仪、BGISEQ-100基因测序仪和胎儿染色体非整倍体(T21、中国T18、无创T13)检测试剂盒(联合探针锚定连接测序法)、产前胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(半导体测序法)医疗器械注册。

上述获批的产品可通过对孕周12周以上的高危孕妇外周血血浆中的游离基因片段进行基因测序,对胎儿染色体非整倍体疾病21-三体综合征、18-三体综合征和13-三体综合征进行无创产前检查和辅助诊断。
国内其他基因测序产品获批情况
除华大外,达安基因的21三体、18三体和13三体检测试剂盒也于6月19日进入国家创新医疗器械特批绿色通道。根据国家食品药品监督管理总局2014年2月7日颁布的《创新医疗器械特别审批程序(试行)》规定:食品药品监管总局受理创新医疗器械特别审批申请后,由创新医疗器械审查办公室组织专家进行审查,并于受理后40个工作日内出具审查意见,这意味着达安基因大约7月下旬即可拿到创新医疗器械注册证。
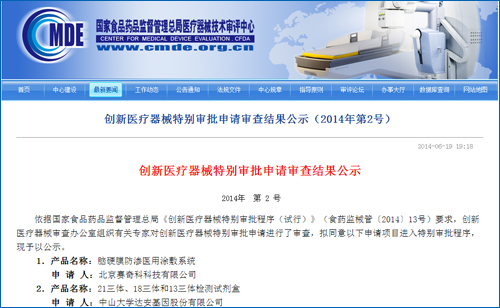
国内基因测序另一领头公司贝瑞和康情况如何?业内人士表示,贝瑞和康的产品还未进入医疗器械分类注册流程。从分类注册到最后审批获得医疗器械许可证,需要较长时间,贝瑞和康何时拿到证还未可知。
新品上市为国内基因测序行业带来新空间
从总体上说,新一代基因测序产品的上市,将一扫之前“卫计委叫停基因测序临床应用”的阴霾,为国内基因测序行业带来新的市场空间。国家食品药品监督管理总局在通知中亦表示,高度关注基因测序诊断产业发展,鼓励创新、加强服务,在相关产品注册工作中精心组织、加强协作、严格审评,在确保产品安全、有效前提下,保证了工作的进度。同时,还组织相关技术部门研制完成基因测序诊断产品相关国家参考品,填补了国际空白。
下一步,国家食品药品监督管理总局将与有关部门密切合作,加强产品上市后质量监管,做好其他创新基因测序诊断产品注册工作,促进相关产业的健康有序发展,让创新医疗器械产品更快、更好地服务广大公众。
相关文章
 东南网6月15日讯福建日报记者 林智岚)日前,国家知识产权局正式公布第二十五届中国专利奖获奖名单,福建交出了一份亮眼成绩单:厦门万泰与厦门大学联合研发的“截短的人乳头瘤病毒16型L1蛋白&2025-06-25
东南网6月15日讯福建日报记者 林智岚)日前,国家知识产权局正式公布第二十五届中国专利奖获奖名单,福建交出了一份亮眼成绩单:厦门万泰与厦门大学联合研发的“截短的人乳头瘤病毒16型L1蛋白&2025-06-25 跨国药企医学准入实力排行榜,GSK居首 2014-11-21 06:00 · ansel Acces2025-06-25
跨国药企医学准入实力排行榜,GSK居首 2014-11-21 06:00 · ansel Acces2025-06-25 粪便作燃料:英国首辆生物燃料公交车上路 2014-11-21 08:37 · 李亦奇 据英国《每日邮2025-06-25
粪便作燃料:英国首辆生物燃料公交车上路 2014-11-21 08:37 · 李亦奇 据英国《每日邮2025-06-25 跨国药企医学准入实力排行榜,GSK居首 2014-11-21 06:00 · ansel Acces2025-06-25
跨国药企医学准入实力排行榜,GSK居首 2014-11-21 06:00 · ansel Acces2025-06-25 12日,福州市政协召集各界别政协委员、相关部门代表,并邀请企业代表围绕“破解不动产登记遗留问题,优化营商环境产权流转”主题展开微协商活动。大家互动交流、共寻解决良策,为杨桥河南2025-06-25
12日,福州市政协召集各界别政协委员、相关部门代表,并邀请企业代表围绕“破解不动产登记遗留问题,优化营商环境产权流转”主题展开微协商活动。大家互动交流、共寻解决良策,为杨桥河南2025-06-25 移动医疗进入后流量时代 谁来买单? 2014-11-30 06:00 · 李亦奇 问题来了,后流量时2025-06-25
移动医疗进入后流量时代 谁来买单? 2014-11-30 06:00 · 李亦奇 问题来了,后流量时2025-06-25

最新评论